QUÁ TRÌNH KEO TỤ TẠO BÔNG
Trong nước mặt, nước ngầm cũng như nước thải, có rất nhiều chất hoà tan, chất keo, chất rắn lơ lửng (nước thải). Xử lý bằng phương pháp keo tụ là cho vào trong nước các chất keo tụ (coagulant). Các chất này sẽ trung hoà các điện tích của các hạt keo hoà tan trong nước, ngăn cản sự chuyển động hỗn loạn của các ion giúp cho việc liên kết tạo bông keo tụ thuận lợi. Đối với nước thải có hàm lượng SS cao, quá trình keo tụ cũng có tác dụng lớn trong việc kết bông cặn để đến quá trình lắng sau đó sẽ loại được các bông cặn này, tức là đã giảm được một lượng SS đáng kể.
1. Cơ chế của quá trình keo tụ
Trong quá trình lắng cơ học chỉ tách được các hạt chất rắn huyền phù có kích thước lớn, còn các hạt nhỏ hơn ở dạng keo không thể lắng được. Ta có thể tăng kích cỡ các hạt nhờ tác dụng tương hỗ giữa các hạt phân tán liên kết vào các tập hợp hạt để có thể lắng được. Muốn vậy, trước hết cần trung hoà điện tích của chúng, tiến đến là liên kết chúng lại với nhau.
Xử lý bằng phương pháp keo tụ là cho vào trong nước một loại hoá chất gọi là chất keo tụ có thể đủ làm cho những hạt rất nhỏ biến thành những hạt lớn lắng xuống. Thông thường quá trình keo tụ tạo bông xảy ra qua hai giai đoạn:
Bản thân chất keo tụ phát sinh thuỷ phân, quá trình hình thành dung dịch keo, và ngưng tụ. Trung hoà hấp phụ lọc các tạp chất trong nước. Kết quả của quá trình trên là hình thành các hạt lớn lắng xuống.
Những hạt rắn lơ lửng mang điện tích âm trong nước (keo sét, protein …) sẽ hút các ion dương tạo ra hai lớp điện tích dương bên trong và bên ngoài. Lớp ion dương bên ngoài liên kết lỏng lẻo nên có thể dể dàng bị trợt ra. Như vậy điện tích âm của hạt bị giảm xuống. Thế điện động hay thế zeta bị giảm xuống.
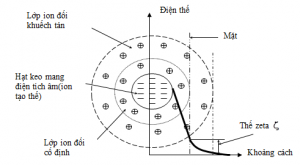
Mục tiêu đề ra là giảm thế zeta, tức là giảm chiều cao của hàng rào năng lượng đến giá trị giới hạn, sao cho các hạt rắn không đẩy lẫn nhau bằng cách cho thêm vào các ion có điện tích dương để phá vỡ sự ổn định của trang thái keo của các hạt nhờ trung hoà điện tích. Khả năng dính kết tạo bông keo tụ tăng lên khi điện tích của hạt giảm xuống và keo tụ tốt nhất khi điện tích của hạt bằng không. Chính vì vậy lực tác dung lẫn nhau giữa các hạt mang điện tích khác nhau giữ vai trò chủ yếu trong keo tụ. Lực hút phân tử tăng nhanh khi giảm khoảng cách giữa các hạt bằng các tạo nên những chuyển động khác nhau được tạo ra do quá trình khuấy trộn.
* Cơ chế của quá trình keo tụ là làm mất đi sự ổn định của dung dịch keo có trong nước bằng các biện pháp:
Nén lớp điện tích kép dược hình thành giữapha rắn và lỏng: giảm điện thế bể mặt bằng hấp phụ và trung hoà điện tích. Hình thành các cầu nối giữa các hạt keo. Bắt giữ các hạt keo vào bông cặn.
1.1. Cơ chế trung hoà điện tích:
Hấp thụ các ion hay phân tử mang điện tích trái dấu với điện tích của hạt keo. Liều lượng chất keo tụ tối ưu cho vào sao cho điện thế zeta bằng 0 mV. Giảm thế năng bề mặt tức là giảm điện thế zeta khi đó sự đẩy tĩnh điện của các hạt keo giảm xuống và có khả năng kết nối lại nhờ lực tương tác tĩnh điện, khi đó hệ keo mất đi tính ổn định. Tăng hàm lượng chất keo tụ, nếu lượng chất keo tụ cho vào quá nhiều sẽ gây hiện tượng keo tụ quét bông. Quá trình này làm tăng hiệu quả keo tụ lên, hệ keo cũng bị mất ổn định.
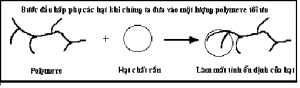
1.2. Cơ chế tạo cầu nối
Để tăng cường quá trình keo tụ tạo bông người ta cho thêm vào các hợp chất polymer trợ keo tụ. Các polymer này tạo sự dính kết giữa các hạt keo lại với nhau nếu polymer này và các hạt keo trái dấu nhau.
Cơ chế tạo cầu nối sảy ra ở 5 phản ứng:
Phản ứng 1: hấp phụ ban đầu ở liều polymer tối ưu, phân từ polymer sẽ kết dính vào hạt keo
Phản ứng 2: hình thành bông cặn. Đuôi polymer đã hấp phụ có thể duổi ra gắn kết vị trí trống trên bề mặt hạt keo khác dẫn đến việc hình thành bông cặn.
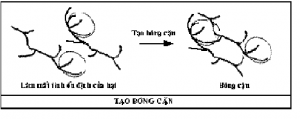
Phản ứng 3: hấp phụ lần 2 của polymer. Nếu đoạn cuối cùng duỗi ra và không tiếp xúc với vị trí trống trên hạt khác thì polymer sẽ gấp lại và tiếp xúc với mặt khác của chính hạt đó. Nguyên nhân gây ra là do khuếch tán chậm hay độ đục hoặc mật độ hạt keo trong nước thấp. Phản ứng 4: khi liều lượng polymer dư làm cho bề mặt hạt keo bảo hoà các đoạn polymer điều này làm cho không còn vị rtí trống để hình thành cầu nối đưa đến hệ keo sẽ ổn định lại. Phản ứng 5: vỡ bông cặn. Khi xáo trộn quá lâu hoặc quá nhanh làm cho các bông cặnbị phá vỡ và trở vể trạng thái ổn định ban đầu.
1.3. Các yếu tố ảnh hưởng đến quá trình keo tụ
Quá trình keo tụ phụ thuộc vào hai cơ chế chính là trung hoà điện tích và hấp phụ tạo cầu nối. Vì thế các yếu tố nào ảnh hưởng đến hai quá trình trên điền gây ảnh hưởng đến quá trình keo tụ tạo bông.
Ảnh hưởng của pH Nhiệt độ nước Liều lượng chất keo tụ và chất trợ keo tụ Tạp chất trong nước Tốc độ khuấy trộn Môi chất tiếp xúc: nếu trong nước duy trì một lớp cặn bùn nhất định, khiến cho quá trình kết tủa càng hoàn toàn, tốc độ kết tủa tăng.
Ảnh hưởng của pH (quyết định quá trình thuỷ phân của chất keo tụ trong dung dịch) đến quá trình keo tụ là ảnh hưởng quan trọng nhất quyết định hiệu suất của việc xử lý.
2. Chất keo tụ
Trước đây người ta thường dùng quá trình keo tụ để khử bớt chất rắn lơ lửng, sau đó là BOD của nước thải khi có sự biến động lớn về SS, BOD của nước thải cần xử lý theo mùa vụ sản xuất; khi nước thải cần phải đạt đến một giá trị BOD, SS nào đó trước khi cho vào quá trình xử lý sinh học và trợ giúp cho các quá trình lắng trong các bể lắng sơ và thứ cấp. Các hóa chất thường sử dụng cho quá trình này được liệt kê trong bảng. Hiệu suất lắng phụ thuộc vào lượng hóa chất sử dụng và yêu cầu quản lý. Thông thường nếu tính toán tốt quá trình này có thể loại được 80 ¸ 90% TSS, 40 ¸ 70% BOD5, 30 ¸ 60% COD và 80 ¸ 90% vi khuẩn trong khi các quá trình lắng cơ học thông thường chỉ loại được 50 ¸ 70% TSS, 30 ¸ 40% chất hữu cơ.
Các hóa chất thường sử dụng trong quá trình keo tụ
| Tên hóa chất | Công thức | Trọng lượng phân tử | Trọng lượng riêng, lb/ft3 | |
| Khô | Dung dịch | |||
| Phèn nhôm | Al2(SO4)3.18H2O Al2(SO4)3.14H2O | 666,7 594,3 | 60,75 60,75 | 78,80 (49%) 83,85 (49%) |
| Ferric chloride | FeCl3 | 162,1 | 84,93 | |
| Ferric sulfate | Fe2(SO4)3 Fe2(SO4)3.3H2O | 400 454 | 70,72 | |
| Ferric sulfate (copperas) | FeSO4.7H2O | 278,0 | 62,66 | |
| Vôi | Ca(OH)2 | 56 | 35,5 | |
Ghi chú: 1 lb/ft3 = 16,0185 kg/m3
Ngoài ra còn có một số chất keo tụ thường được sử dụng như :
Phèn nhôm: NaAlO2 , Al2(OH)5Cl , KAl(SO4)2H2O, NH4Al(SO4)2.12H2O
Phèn sắt: Fe2(SO4)3.2H2O
Các muối sắt có ưu điểm so với muối nhôm trong việc làm keo tụ các chất lơ lửng của nước:
– Tác dụng tốt hơn ở nhiệt độ thấp
– Khoảng pH tác dụng rông hơn
– Tạo kích thước và độ bền bông keo lớn hơn
– Có thể khử được mùi vị khi có H2S
Nhưng sắt cũng có nhược điểm: tạo phức hoà tan làm cho nước có màu do phản ứng của Cation sắt với một số chất hữu cơ.
Trong quá trình tạo thành bông keo của hydroxit nhôm hoăc sắt, người ta thường dùng thêm chất trợ keo tụ. Các chất trợ keo tụ này là tinh bột, dentrin (C6H10O5)n, các ete, xenlulozơ, dioxit silic hoạt tính (xSiO2.yH2O), sét Bentonite … với liều lượng khoảng 1 – 5 mg/l. ngoài ra người ta còn dùng các chất trợ keo tụ tổng hợp như chất polyacrylamit (CH2CHCONH2)n (PAC), polyacrylic (CH2CHOOH)n hoặc polydiallydimetyl-amôn.
(nguồn: Công nghệ xử lý nước thải bằng phương pháp sinh học – Lương Đức Phẩm)
Liều lượng chất keo tụ ứng với hàm lượng khác nhau của các tạp chất trong nước thải:
| Nồng độ tạp chất trong nước thải | Liều lượng chấ kẹo tụ khan (mg/l) |
| Từ 1-100 | 25-35 |
| 101-200 | 30-45 |
| 201-400 | 40-60 |
| 401-600 | 45-70 |
| 601-800 | 55-80 |
| 801-1000 | 60-90 |
| 1001-1400 | 65-105 |
| 1401-1800 | 75-115 |
| 1801-2200 | 80-125 |
| 2201-2500 | 90-130 |
Trong thực tế người ta xác định hàm lượng phèn tối ưu và pH tối ưu cho quá trình keo tụ tao bông bằng thí nghiệm Jartest.
3. Sử dụng hóa chất để loại chất rắn lơ lửng
Phèn nhôm: khi được thêm vào nước thải có chứa calcium hay magnesium bicarbonate phản ứng xảy ra như sau:
Al2(SO4)3.18H2O + 3Ca(HCO)3 → 3CaSO4 + 2Al(OH)3 + 6CO2 + 18H2O
Aluminum hydroxide không tan, lắng xuống với một vận tốc chậm kéo theo nó là các chất rắn lơ lửng. Trong phản ứng tên cần thiết phải có 4,5 mg/L alkalinity (tính theo CaCO3) để phản ứng hoàn toàn với 10 mg/L phèn nhôm. Do đó nếu cần thiết phải sử dụng thêm vôi để alkalinity thích hợp.
Vôi: khi cho vôi vào nước thải các phản ứng sau có thể xảy ra:
Ca(OH)2 + H2CO3 → CaCO3 + 2H2O
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
Quá trình lắng của CaCO3 sẽ kéo theo các chất rắn lơ lửng.
Sulfate sắt và vôi: trong hầu hết các trường hợp sulfate sắt không sử dụng riêng lẻ mà phải kết hợp với vôi để tạo kết tủa. Các phản ứng xảy ra như sau:
FeSO4 + Ca(HCO3)2 → 2Fe(HCO3)2 + CaSO4 + 2H2O
Fe(HCO3)2 + Ca(OH)2 → 2Fe(OH)2 + 2CaCO3 + 2H2O
4Fe(OH)2 + O2 + 2H2O →4Fe(OH)3
Khi Fe(OH)3 lắng xuống nó sẽ kéo theo các chất rắn lơ lửng. Trong các phản ứng này ta cần thêm 3,6 mg/L alkalinity, 4,0 mg/L vôi và 0,29 mg/L oxy.
Ferric chloride: phản ứng xảy ra như sau:
FeCl3 + 3H2O → Fe(OH)3 + 3H+ + 3Cl-
3H+ + 3HCO3- → 3H2CO3
Ferric chloride và vôi: phản ứng xảy ra như sau:
FeCl3 + Ca(OH)2 → 3CaCl2 + 2Fe(OH)3
Ferric sulfate và vôi: phản ứng xảy ra như sau:
Fe2(SO4)3 + Ca(OH)2 → 3CaSO4 + 2Fe(OH)3